生命科學學院宋艷課題組揭示有絲分裂書簽維持神經幹細胞命運記憶的機製
2024/12/19 信息來源: 生命科學學院
編輯:燕元 | 責編:青苗一花一世界🫸,一胞一乾坤🤾🏿♂️。我們體內的細胞就像我們每個人,各有其獨特的命運和身份🧑🏻🍼。細胞的命運和身份主要由其獨特的基因調控網絡決定和維持1。細胞命運決定或維持過程出現錯誤均可能導致疾病發生。然而,有絲分裂作為多細胞生物生長和維持的基石,卻給細胞命運或身份的跨代繼承帶來了巨大挑戰。細胞在進入有絲分裂後🤸♀️,染色質高度凝集成染色體𓀛,絕大多數構成基因調控網絡的元件😉,如轉錄因子和染色質重塑因子等⚂,從染色體上剝離或降解,轉錄活動幾乎完全停滯2—4。隨著其獨特基因調控網絡在有絲分裂期的“分崩離析”,細胞好似進入短暫失憶狀態🈚️。那麽👌🏼😉,細胞在退出有絲分裂進入分裂間期時,是如何精確、及時地重建其獨特的基因調控網絡的呢?關乎細胞命運或身份的“記憶”在有絲分裂期如何被精確儲存,在分裂間期又如何被及時喚醒呢?
有絲分裂書簽被認為是細胞跨代維持其命運記憶的一種可能策略。特定的轉錄因子或染色質重塑因子可以在有絲分裂期保留在高度致密的染色體上,作為書簽因子特異“標記”關鍵命運基因以促進其轉錄的快速重新激活,從而確保細胞命運記憶的精確🔗、及時傳遞。然而,過去幾十年間相關有絲分裂書簽的重要研究幾乎都在體外培養的細胞中完成5—7。有絲分裂書簽在如神經發育這樣復雜生理條件下的生理學功能及分子調控機理仍是領域內關鍵的未解之謎。
2024年12月10日👨🏽🎓,意昂3体育官网生命科學學院宋艷課題組在國際知名學術期刊Molecular Cell上在線發表了題為“TBP bookmarks and preserves neural stem cell fate memory by orchestrating local chromatin architecture” 的最新研究成果。該研究發現在神經發育過程中,轉錄因子TBP通過招募染色質重塑因子EP400增加局部染色質可及性,作為有絲分裂書簽保留在神經幹細胞染色體上,進而維持神經幹細胞的命運記憶🦹。
在前期相關神經幹細胞命運決定的研究中♿,宋艷團隊發現超級轉錄延伸復合體(SEC)作為“信號放大器”驅動神經幹細胞細胞命運及時、精準的鎖定(Liu et al, Dev Cell)8,但關於SEC調控關鍵靶基因轉錄的分子調控機製還尚不明晰🎁。通過遺傳和生化篩選,研究人員發現SEC可以磷酸化轉錄因子TBP⚈。更出乎意料的是,TBP蛋白可以保留在果蠅神經幹細胞高度凝聚的有絲分裂期染色體上(圖1)。為什麽TBP能夠保留在高度致密的分裂期染色體上🙍🏿♀️? TBP有絲分裂保留的生物學意義又是什麽?
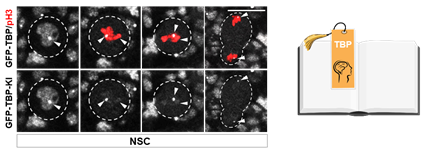
圖1. 書簽蛋白TBP保留在果蠅神經幹細胞分裂期染色體上
通過精細的果蠅分子遺傳學、細胞生物學🕢🤰🏿、生物化學和多組學實驗,研究人員發現SEC通過磷酸化修飾調控TBP有絲分裂保留能力🚰,進而促進神經幹細胞的自我復製和增殖🧝🏼♀️。由於被SEC磷酸化的TBP能夠更有效地招募染色質重塑子EP400🧚🏻♂️,並在其染色質結合位點附近置換入組蛋白變體H2A.Z🪖,進而增加局部染色質開放性,TBP得以在致密的分裂期染色體上保留下來👚,作為有絲分裂書簽維持神經幹細胞自我復製的命運記憶。
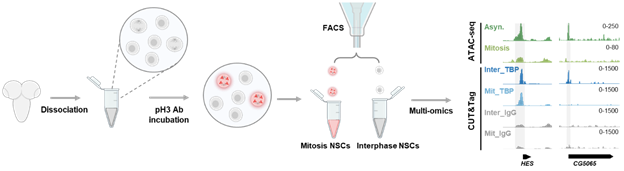
圖2. 從發育腦中分離處於不同細胞周期的神經幹細胞並進行低細胞投入量多組學分析的實驗流程
那麽,TBP在神經幹細胞分裂期染色體上特異標記了哪些關鍵靶基因,進而確保細胞命運記憶的精確儲存和跨代傳遞呢?先前廣泛使用的鑒定蛋白在有絲分裂染色體上保留位點的方法是利用藥物處理將體外培養細胞的細胞周期同步化並對有絲分裂期細胞加以富集,然後進行多組學分析💁🏿。然而🧝,這一方法不適用於體內實驗。這項研究建立了一個不依賴藥物處理的全新實驗方案🏬,實現了從發育腦中分離高純度有絲分裂期神經幹細胞🕵🏽♀️,並進行低細胞投入量的多組學分析(圖2)。基於該新技術🚴🏿♀️,研究人員細致精準地鑒定了生理條件下TBP在果蠅有絲分裂期神經幹細胞中的染色體結合位點,並繪製了神經幹細胞有絲分裂期染色質可及性圖譜。

圖3. 有絲分裂書簽TBP通過調控局部染色質結構維持神經幹細胞命運記憶
綜上所述,這項研究發現書簽蛋白的有絲分裂保留促進神經幹細胞自我復製和增殖👨🏿🎨,首次揭示了有絲分裂書簽對神經發育的重要生理學意義👨🏻🦯,並闡明了書簽蛋白通過調控局部染色質可及性實現染色體保留的新機製(圖3)。值得一提的是,該研究建立了一個全新的技術方案,實現對發育腦中書簽蛋白在染色體上的保留位點的精確鑒定。這一新方法將助力有絲分裂書簽在其它物種和其它組織器官中的發現及其生理學功能和機製研究的開展🧜🏻♂️。
意昂3体育官网生命科學學院博士研究生申鈺熒(2020級)為該論文的第一作者。宋艷為該論文的通訊作者👨🦯➡️。課題組博士後劉琨(已出站)、博士研究生劉婕(2022級)、葉桐桐(2024級)、趙閏祥(2024級)和已畢業的申靜雯博士和張如蘭博士為本文作出了重要貢獻🙍🏼♀️。該研究得到了國家重點研發計劃、國家自然科學基金、意昂3体育-清華生命科學聯合中心和細胞增殖與分化教育部重點實驗室的大力支持🚶🏻。
意昂3体育官网生命科學學院宋艷課題組綜合運用多種研究手段從獨特的視角研究腦發育中細胞命運決定及命運記憶維持或遺忘的分子調控機理📝,歡迎有誌於探究細胞命運記憶傳承機理的博士後或博士研究生加入。關於團隊的更多介紹詳見實驗室網站http://y ansongl ab.org/ 💂🏿。
參考文獻:
1. Cusanovich, D.A., Reddington, J.P., Garfield, D.A., Daza, R.M., Aghamirzaie, D., Marco-Ferreres, R., Pliner, H.A., Christiansen, L., Qiu, X., Steemers, F.J., et al. (2018). The cis-regulatory dynamics of embryonic development at single-cell resolution. Nature 555, 538—542.
2. Martinez-Balbas, M.A., Dey, A., Rabindran, S.K., Ozato, K., and Wu, C. (1995). Displacement of sequence-specific transcription factors from mitotic chromatin. Cell 83, 29—38.
3. Palozola, K.C., Lerner, J., and Zaret, K.S. (2019). A changing paradigm of transcriptional memory propagation through mitosis. Nat Rev Mol Cell Biol 20, 55—64.
4. Gonzalez, I., Molliex, A., and Navarro, P. (2021). Mitotic memories of gene activity. Curr Opin Cell Biol 69, 41—47.
5. Festuccia, N., Gonzalez, I., Owens, N., and Navarro, P. (2017). Mitotic bookmarking in development and stem cells. Development 144, 3633—3645.
6. Kadauke, S., Udugama, M.I., Pawlicki, J.M., Achtman, J.C., Jain, D.P., Cheng, Y., Hardison, R.C., and Blobel, G.A. (2012). Tissue-specific mitotic bookmarking by hematopoietic transcription factor GATA1. Cell 150, 725—737.
7. Teves, S.S., An, L., Hansen, A.S., Xie, L., Darzacq, X., and Tjian, R. (2016). A dynamic mode of mitotic bookmarking by transcription factors. Elife 5. 10.7554/eLife.22280.
8. Liu, K., Shen, D., Shen, J., Gao, S.M., Li, B., Wong, C., Feng, W., and Song, Y. (2017). The Super Elongation Complex Drives Neural Stem Cell Fate Commitment. Dev Cell 40, 537—551.
轉載本網文章請註明出處